Сладенький наш. Такого обращения достоин глицерин . Его вкус напоминает глюкозу. Оба вещества – быстроусваиваемые источники энергии. Оба соединения природного происхождения.
Глицерин можно найти, к примеру, в сале. Впрочем, герой входит во все жиры. Они, собственно, являются соединением глицерина с жирными кислотами. Последние известны потребителям под именем «Омега-3».
Все кислоты класса относятся к карбоновым, то есть содержат группу СООН. А вот чего нет в «Омега-3», так это ароматических связей. То есть, жирные относятся к алифатическим. Остается выяснить, что есть глицерин.
Что такое глицерин?
Глицерин относится к трехатомным спиртам. Так именуют органические соединения, в которых 3 группы НО. Они называются гидроксилами. В трехатомных спиртах каждый из них прикреплен к отдельному атому .
Общая запись соединений : — CnH 2 n-1(OH) 3 . Формула глицерина : — НОСН 2 -СНОН-СН 2 ОН. Научное название вещества – 1, 2, 3-пропантриол. «Триол» — обязательный суффикс для трехатомных спиртов.

Структурная формула глицерина
«Пропан» — основной алкан. Алканами в химии именуют . То есть, в основе глицерина лежит линейный углеводород с одними лишь простыми связями.
Какой глицерин внешне? Бесцветный, вязкий. Консистенция напоминает сироп. Аромат отсутствует. О сладком вкусе говорилось. Из физических свойств остается указать хорошую растворимость в воде и гигроскопичность. Последнее свойство обозначает способность вещества впитывать атмосферную влагу. За счет нее герой статьи может увеличиваться в объеме на 40%.
Хоть глицерин трехатомный, его химические свойства типичны для одноатомных спиртов. Соединение горюче. При воспламенении глицерина выделяются углекислый и вода. Если же идет взаимодействие с активными металлами, выделяется .
Последний взрывоопасен при нагреве и контакте с . Тоже касается тринитроглицерина. Он получается в ходе реакции между героем статьи и азотистой кислотой. Тринитроглицерин маслянист, более вязок, нежели предшественник.
Реакцией определения глицерина служит взаимодействие с гидроксидом двухвалентной . Раствор становится . Это цвет образовавшегося алкоголята меди. Его второе название – глицерат. Вещество получится лишь в случае использования чистого глицерина. С загрязненным спиртом гидроксид меди не взаимодействует.
Есть и еще одна качественная реакция. Ее проводят с порошком перманганата . Вещество насыпают горкой, смачивая парой капель глицерина. Раствор не годится. Нужен безводный спирт. С ним перманганат калия самовоспламеняется и горит . появляется примерно через минуту после смачивания порошка.
Реакция глицерина с перманганатом калия именуется вулканом Шееле. Взаимодействие названо по фамилии химика, впервые его проведшего. Карл Шееле сравнил реакционный процесс с извержением вулкана не только из-за огня, но и разлетающихся во все стороны «бомбочек».

Химическая формула глицерина
Продукты реакции разбрасывает от резкого выброса тепла. Активно выделяется и водяной пар. Он похож на столбы дыма, исходящие от извергающихся вулканов.
Привычный в виде жидкости, герой статьи бывает и . Почему не видим такой глицерин в домашних условиях ? Ответ: из-за комнатных температур.
Трехатомный спирт плавится уже при 16-17-ти градусах Цельсия. При этом, до температуры кипения далеко. Активное парообразование в глицерине начинается почти при 300-от градусах.
Получение глицерина
Уже упоминалось о Карле Шееле. Шведский химик открыл не только качественную реакцию глицерина с перманганатом калия, но и сам спирт. Произошло это в 1779-ом году. Химик нагревал оливковое масло с оксидом .
Получился сладкий раствор. Шееле выпарил его. Осталась вязкая масса. Уже в начале 19-го века ее научились получать промышленным способом. Им пользуются до сих пор. Жиры омыляют гидроксидами.

Параллельно омылению жиров используют способ их обводнения. Определенное количество влаги при нагреве с жиром провоцирует его распад на жирные и глицерин. Остается лишь отделить спирт.
На реакцию уходит около 12-ти часов. Если конечный глицерин перегнать с паром, получится очищенный продукт. Его называют дистиллированным и допускают к приему внутрь.
Учитывая объемы производства в 21-ом веке, маски с глицерином и прочая продукция с героем статьи, могут содержать его синтезированную версию. Ее получают восстанавливая ацетон.
Сначала выходит изопропиловый спирт. От него отнимают воду. Получается глицерин, точнее, глицерол. Так синтетический спирт именуют на Западе, в частности, в Англии. В отдельного названия нет.
Это смущает потребителей. В безопасности природного глицерина сомнений нет. Относительно пользы синтетики есть вопросы. В частности, утверждается, что спирт из ацетона вызывает аллергические реакции .
Учитывая, что глицерин – частый компонент косметики, вопрос важен. Но, повторимся, на упаковках средств российского производства не указывается природа глицерина. Проще приобретать зарубежные крема да . Итак, начнем обсуждение применения спирта со сферы косметологии.
Применение глицерина
Глицерин для лица , рук, тела применяется в качестве увлажняющего компонента. Помните о гигроскопичности спирта? Вбирая влагу из атмосферы, он сосредотачивает ее у поверхности кожи.
Клетки с легкостью захватывают воду. В итоге, кожа гладкая, увлажненная, упругая. Не секрет, что вода – основной компонент клеток, в том числе ее каркаса из коллагена и .
Глицерин применение в косметологии сыскал еще век назад. За это время пользе вещества нашлись контраргументы. В частности, крема с трехатомным спиртом лишние в помещениях с иссушенным воздухом.

Применение глицерина для кожи лица
Из него влагу не вытянешь. Спирт начинает вбирать воду из кожи, оказывая вместо увлажняющего иссушающее действие. Если же купить глицерин и применять его во влажных помещениях, к примеру, в ванной после мытья, коже обеспечено увлажнение.
Кстати, увлажняет трехатомный спирт не только кожу, но и волосы. Тонкий слой средства, распределенный по локонам, исключает их ломкость и сухость. К тому же, глицерин – отличный нутриент, то есть проводник полезных веществ. Если примешать к спирту несколько капель витаминов для волос, их клетки получат питание максимально быстро.
В качестве влагоемкого средства героя статьи применяют и в фармакологии. Таблетки с глицерином проще проглатывать. Компонент всасывается стенками желудка, но не попадает в кровь.
Трехатомный спирт растворяет лекарственные составляющие, способствуя их усваиванию. Свечи с глицерином за счет жирной поверхности легко вводятся. В некоторых средствах спирт смягчает действие основного компонента.
Так, «Люголь» с глицерином и йодом не сжигает слизистые, а лишь обеззараживает горло. Кстати, обеззараживающие свойства есть не только у , но и смягчающего компонента. В этом качестве глицерин применяется медиками при заболеваниях кожи. Трехатомный спирт прописывают как антисептик для ран и язв.

Мыло глицериновое
При приеме внутрь инструкция к глицерину содержит несколько рекомендаций. Первая – облегчение последствий инсульта. Он сопровождается отеком мозга, то есть, переизбытком жидкости в нем. Гигроскопичность героя стати помогает «откачать» часть воды. Однако, существуют более действенные препараты. Глицерин применяют за их неимением.
Вторая рекомендация для приема глицерина внутрь – глаукома. Это заболевание сопровождается периодическим повышением внутриглазного давления. Подобный эффект наблюдается, так же, после операций на органе зрения. Глицерин уменьшает размеры стекловидного тела, уменьшая и давление. В борьбе с ним спирт выбирается с учетом минимальных побочных действий.
Кроме косметологии и медицины глицерин отзывы собирает в сфере питания. Сладковатый спирт добавляют в кондитерские изделия. Им глицерин придает пышность. К тому же, добавка исключает почернения на булочках и паляницах. Последний термин применяют к лепешкам с начинками.

Глицерин для волос
Добавляют героя статьи и в жевательные резинки. Помните песню «Сплина» «Орбит без сахара». Жуя, жуя его, не задумывались, откуда все-таки сладость? Это глицерин и прочие заменители . В газировках, кстати, они тоже присутствуют.
Есть глицерин и во многих макаронах. В них герой статьи выступает в роли съедобного клея, скрепляя компоненты. Кстати, на упаковках трехатомный спирт отображается как «Е422».
Требование к добавке — минимум 99% глицерина. То есть, в пищевую промышленность допускают чистое соединение. В аптечном, техническом и специальном спиртах содержание героя статьи меньше, а примесей больше.
Глицерин не только добавляется внутрь продуктов, но и наносится на их поверхность. Это придает пище лоск. Глицерином, к примеру, смазывают сухофрукты и фрукты, некоторые овощи. Шкурки начинают сиять, при этом, остаются безвредными.

В бытовой сфере глицерин – главный компонент электронных сигарет. Герой статьи добавляется в их картриджи, дабы смягчать вкус и удерживать влагу. Без глицерина сигареты меньше хранятся. Кстати, в жидкость для курения спирт тоже входит. Применяют глицерин и к обычному табаку. Герой статьи поглощает его запах и не дает пересыхать.
Не дает пересыхать глицерин, так же, семенам. Поэтому, препарат полюбился аграриям и дачникам. Они смазывают спиртом посевной материал. Глицерин начинает вбирать влагу из почвы, ускоряя прорастание. Если же трехатомным спиртом обмазать кору , он выступит в роли антисептика, защищая от вредителей.
Лоснение глицерина видно в ряде кремов для . Правда, добавка в них героя статьи делает смеси клейкими. К обуви начинает прилипать пыль. Зато, крема с глицерином бюджетны и годятся для смазки ботинок, если в планах нет прогулки по улице.
Цена глицерина
Цена средства зависит от его типа. За кило технического глицерина просят от 40-ка рублей. Верхняя планка – около 140 рублей. Кило пищевого спирта стоит от 70-ти до 200-от рублей. Соблюдается ГОСТ «6824-96».
Кстати, существует безводная форма спирта. Она, в отличие от раствора, агрессивна для кожи и слизистых, но выгоднее при покупке. Некоторые производители разводят глицерин самостоятельно.
Зависит глицерина и от типа получения. Синтетический вариант спирта, как правило, дешевле. Указывают на природу происхождения вещества, в основном, зарубежные производители. Но, практика начинает перениматься и россиянами.
Так о синтетической природе своего товара заявляет краснодарское предприятие «Югтехком». Подкупает чистота предлагаемого глицерина, составляющая 99,9%. Соблюден ГОСТ «259-75». на глицерин компании договорная.
Описание продукта.
Glycerin (глицерин) – органическое соединение, относящееся к полиолам - спиртам, содержащим в молекуле несколько гидроксильных групп. Этиленгликоль и глицерин, имеющие соответственно две и три гидроксильные группы, являются самыми простыми по структуре полиспиртами. Изомерия трехатомных спиртов, как и двухатомных, определяется строением углеродной цепи и положением в ней трех гидроксильных групп.
История продукта.
Глицерин был открыт в 1779 г. шведским исследователем Карлом Шееле, который обнаружил, что при нагревании оливкового масла с оксидом свинца образуется раствор сладкого вкуса. Дальнейшее выпаривание раствора позволило ему получить сиропообразную тяжелую жидкость. В 1811 г. Мишель Эжен Шеврель, французский химик-органик, изучая состав сладкой вязкой жидкости, впервые назвал ее глицерином.
HОСН 2 -СHOH-СН 2 ОН.
Первый промышленный способ получения глицерина был открыт в 1811 г. Мишель Эжен Шеврель омылением нейтральных жиров гидроксидами с последующим извлечением глицерина из подмыльных щелоков. Этот способ до сих пор используют во всех странах мира.
Второй промышленный способ получения глицерина был открыт в 1853 г. А.Тилгманом. При интенсивном перемешивании и давлении нагретые с водой жиры расщепляют на жирные кислоты и глицерин, причем при температуре 175-200 °С процесс длится 10-12 ч. Жирные кислоты при охлаждении всплывают на поверхность глицериновой воды. Этим способом в настоящее время преимущественно получают глицерин в нашей стране.
Следующим важным шагом в развитии глицеринового производства явилось опубликование Вильсоном в 1856 г. описания метода перегонки глицерина с водяным паром, позволяющего получать глубокоочищенный дистиллированный продукт.
В 1898 г. был разработан метод Твитчеля, заключающийся в расщеплении жиров в присутствии эмульгаторов - сульфокислот. Один из видов катализаторов для расщепления жиров по методу Твитчеля получали взаимодействием бензола, нафталина, жирных кислот и серной кислоты. . Недостатком метода является длительность процесса расщепления (40 ч) и значительное потемнение продуктов гидролиза.
В 1912 г. Г.С.Петров предложил в качестве ускорителя контактного расщепления использовать сульфонефтяные кислоты.
При методе Петрова снижалась продолжительность процесса расщепления до 23-26 ч, повышалась глубина расщепления до 92%, снижался расход пара, уменьшалось содержание примеси в глицериновой воде, образовывались более светлые жирные кислоты. Новый метод быстро распространился в Америке, Европе и России.
Основные способы получения
1. Глицерин можно получать гидролизом (омылением) растительных или животных жиров (в присутствии щелочей или кислот):
O
H 2 C-O-C // -C17H 35
H 2 C-OH
|
O
|
HC-O-C // -C 17 H 35 + 3 H 2 O
R HC-OH + 3C 17 H 35 COOH
|
О
|
H 2 C-O-C // -C 17 H 35
H 2 C-OH
триглицерид (жир)
глицерин стеариновая
кислота
Гидролиз в присутствии щелочей приводит к образованию натриевой или калиевой солей высших кислот - мыла (поэтому этот процесс называется омылением).
2. Синтез из пропилена (промышленный способ):
CH 3
CH 2 Cl
| Cl2, 450-500 o C
| H2O (гидролиз)
CH ----R CH ----R
|| -HCl
||
-HCl
CH 2
CH 2
пропилен хлористый
аллил
CH 2 OH HOCl (гипо- CH 2 OH
CH 2 OH
|
хлорирование)
| H2O
(гидролиз) |
RCH ----R
CHOH ----R CHOH
||
-HCl
|
-HCl
|
CH 2
CH 2 CL
CH 2 OH
аллиловый
монохлор-
глицерин
спирт
гидрин
глицерина
Химические свойства
глицерина сходны с химическими свойствами одноатомных спиртов. Так, например,
многоатомные спирты реагируют с активными металлами.
Подобно одноатомным спиртам, они реагируют с галогеноводородами.
Для многоатомных спиртов характерны и некоторые специфические химические
свойства.
Многоатомные спирты обладают слабыми кислотными свойствами. Накопление
гидроксильных групп в их молекулах придаёт большую подвижность атомам водорода
по сравнению с одноатомными спиртами. Это результат взаимного влияния
гидроксильных групп друг на друга.
Физические свойства.
Глицерин сочетает в себе такие уникальные характеристики, как вязкость, гигроскопичность и растворимость. низкая температура замерзания растворов Кроме того, он устойчив, прозрачен, не портится, без запаха, сладкий на вкус и не токсичен.
Области применения глицерина
Военное дело
Глицерин используют для получения нитроглицерина, из которого производят динамит, бездымный порох и другие взрывчатые вещества, применяемые в мирных целях и военном деле, используют в качестве незамерзающих растворов в различных двигателях, тормозной и нагревающей жидкости, для охлаждения стволов орудий.
Табачная промышленность
Благодаря высокой гигроскопичности глицерин используют для регулирования влажности табака с целью устранения неприятного раздражающего вкуса.
Производство пластических масс
Глицерин является ценной составной частью при получении пластмасс и смол. Эфиры глицерина широко применяют в производстве прозрачных упаковочных материалов. Например, целлофан обладает отличной гибкостью и не теряет своих свойств ни в жаре, ни в холоде.
Пищевая промышленность
Глицерин используют для приготовления экстрактов чая, кофе, имбиря и других растительных веществ, которые измельчают, увлажняют и обрабатывают глицерином, нагревают и извлекают водой для получения экстракта, содержащего около 30 % глицерина.
Глицерин широко применяют при производстве безалкогольных напитков. Глицерин используют при получении горчицы, желе и уксуса.
Сельское хозяйство
Глицерин используют при обработке семян и сеянцев. Разбавленные растворы глицерина помогают прорастанию овса и других злаков.
Медицинская промышленность
Глицерин находит широкое применение в медицине и производстве фармацевтических препаратов. Глицерин обладает антисептическими свойствами, поэтому его применяют для предотвращения заражения ран.
Электротехника и радиотехника
В радиотехнике глицерин широко используют в производстве электролитических конденсаторов. Глицерин используют при производстве алкидных смол, которые применяют как изоляционный материал.
Текстильная, бумажная и кожевенная отрасли промышленности
Глицерин в текстильной промышленности применяют в прядении, ткачестве, печатании, крашении и шлихтовании. Глицерин придает тканям эластичность и мягкость. Его используют для получения анилиновых красок, растворителей для красок, а также в качестве антисептической и гигроскопической добавки к краскам для печатания. Глицерин широко используют при производстве синтетического шелка и шерсти. В бумажной промышленности глицерин применяют при выпуске кальки, пергамента, папиросной бумаги, бумажных салфеток и жиронепроницаемой бумаги.
В кожевенной промышленности глицерин добавляют к водным растворам хлорида бария, который используют в качестве препарата для консервирования кож. Глицерин является одним из компонентов восковых эмульсий для дубления кож.
Лакокрасочная промышленность
Глицерин - ценный компонент полировочных составов, особенно лаков, применяемых для окончательной отделки.
Производство моющих и косметических средств
Большое количество сортов туалетного мыла содержит глицерин, который усиливает его моющую способность, придает белизну коже и смягчает ее. Глицериновое мыло способствует удалению красящих веществ кожи, загоревшей на солнце.
В косметике полиолы используются в качестве увлажнителей. Глицерин - натуральный продукт, получаемый при гидролизе растительных масел. Обладая гигроскопичными свойствами, он увлажняет кожу, придавая ей мягкость и эластичность.
Другие области применения
Для изготовления замазок, гектографической массы, копировальных чернил, штемпельных красок, в кожевенном деле и для других целей.
Описание продукта. Glycerin (глицерин) – органическое соединение, относящееся к полиолам - спиртам, содержащим в молекуле несколько гидроксильных групп. Этиленгликоль и глицерин, имеющие соответственно две и три гидроксильные группы, являются самЦель опытов с глицерином - ознакомить учащихся с теми свойствами, которые обусловливают применение этого вещества в повседневной жизни, и показать, что глицерин является многоатомным спиртом (имеет как общие с одноатомными спиртами реакции, так и отличные от них).
^ Растворимость глицерина в воде . В демонстрационную пробирку (или небольшой цилиндр) наливают 5-7 мл глицерина и сверху по стенке прибавляют такой же объем подкрашенной (например, фуксином) воды. При встряхивании жидкость становится однородной и окрашивается равномерно.
^ Понижение точки замерзания водных растворов глицерина . Водные растворы глицерина (и этиленгликоля) применяются в качестве незамерзающих жидкостей для охлаждения моторов автомашин и самолетов.
а) Пробирку с полученным в предыдущем опыте водным раствором глицерина помещают в охладительную смесь (лед с поваренной солью). Одновременно в смесь помещают пробирку с водой. Через несколько минут убеждаются в том, что вода в пробирке замерзла, раствор же глицерина остался жидким.
Б) Ученики могут провести исследование и определить: при каком процентном содержании глицерина в воде раствор перестает замерзать на улице в зимнее время.
Для этого готовят растворы следующих концентраций: 5%, 10%, 15%, 20% и т.д. - выставляют их на улицу в «мягкий» зимний день и затем в морозный. Отмечают температуру воздуха и устанавливают, начиная с какой концентрации растворы глицерина при данной температуре не замерзают.
^ Гигроскопичность глицерина . Свойство глицерина поглощать влагу и тем самым увлажнять предметы используется, например, для смягчения кожи.
На лист фильтровальной бумаги наносят несколько капель глицерина. На другой лист наносят столько же капель воды. К концу урока убеждаются, что бумага с водой высохла, а бумага с глицерином стала еще более влажной.
^ Горение глицерина. Демонстрация этого опыта важна тем, что позволяет устранить встречающееся иногда у учащихся неверное представление, будто с увеличением числа атомов углерода в молекуле органического вещества непременно возрастает светимость пламени. Это заключение у них появляется из сопоставления горения метана и этилена. Глицерин содержит три атома углерода в молекуле и тем не менее горит почти бесцветным пламенем, так как он богат кислородом и в процентном отношении содержит углерода меньше, чем этилен.
В небольшой пробирке или в тигельке нагревают до кипения 1 мл глицерина и поджигают выделяющиеся пары. Они горят почти бесцветным пламенем. Может оказаться, что глицерин сразу не загорается из-за присутствия в нем воды; в таком случае он должен быть предварительно обезвожен интенсивным нагреванием.
^ Реакция глицерина с натрием . Опыт демонстрирует общность свойств глицерина со спиртами.
В пробирку с 1-2 мл глицерина бросают очищенный кусочек натрия величиной с горошину. Пробирку слегка подогревают. Реакция идет вначале медленно, затем все более энергично.
Поджигают выделяющийся водород. Обычно под конец происходит обугливание глицерина.
^ Реакция с гидроксидом меди . С увеличением числа гидроксильных групп в молекуле вещества возрастает подвижность атомов водорода, т.е. увеличиваются кислотные свойства. Поэтому атомы водорода могут замещаться не только на активные щелочные металлы. Так, например, многоатомные спирты взаимодействуют с гидроксидом меди (уравнение приведено в упрощенном виде):
В демонстрационной пробирке (цилиндре, химическом стакане) получают гидроксид меди, добавляя к 4-5 мл раствора медного купороса раствор щелочи до полного осаждения гидроксида. Для успеха опыта щелочь должна быть непременно в избытке, поэтому, ставя опыт, учитель должен соотнести концентрации имеющихся растворов.
Осадок взбалтывают и половину его переносят в другую пробирку. К одной порции добавляют глицерин, пока при взбалтывании осадок гидроксида не исчезнет и Fie образуется темно-синий раствор. Сравнивают окраску раствора с окраской осадка гидроксида в другой пробирке.
Реакция с гидроксидом меди считается качественной реакцией на многоатомные спирты.
ФЕНОЛ
В данном разделе наиболее существенными являются опыты, показывающие растворимость фенола в щелочи, дезинфицирующее действие его и характер взаимного влияния атомов в молекуле фенола.
Растворимость фенола в воде и щелочах. В пробирку с несколькими кристалликами фенола приливают 2-3 мл воды. Пробирку закрывают пробкой и встряхивают. Убеждаются, что фенол не полностью растворился в воде и образовал непрозрачную эмульсию. Дают эмульсии отстояться, жидкость расслаивается: внизу образуется раствор воды в феноле, вверху - раствор фенола в воде.
Содержимое пробирки снова взбалтывают и к эмульсии фено-
Ла прибавляют по каплям раствор щелочи. Раствор становится прозрачным, так как образующийся фенолят растворим в воде:
С 6 Н 5 ОН + NaOH С 6 Н 5 ОNa + Н 2 О
В этой реакции фенол проявляет кислотные свойства. Это подтверждается и тем, что при действии кислот (добавляют по каплям соляную кислоту) фенол снова выделяется из раствора:
C 6 H 5 ONa + HCI C 6 H 5 ONa + NaCl
^ Фенол - слабая кислота . Для приблизительного определения силы кислоты достаточно установить, какими кислотами она может вытесняться из солей. Фенол слабее угольной кислоты, поэтому при действии угольной кислоты на фенолят натрия образуется фенол:
С 6 Н 5 ОNa + (H 2 CO 3) С 6 Н 5 ОН + NaHCO 3
Раствор фенолята натрия получают, прибавляя раствор щелочи к эмульсии фенола (избегать избытка щелочи!). Далее в него пропускают углекислый газ из аппарата Киппа. Образуется муть вследствие выделения свободного фенола.
^ Реакция фенола с бромной водой . Опыты, на которых можно развить идею о взаимном влиянии атомов в молекулах, имеют большое воспитательное значение. Взаимное влияние атомов можно рассмотреть на примере фенола после ознакомления с его кислотными свойствами.
Большая в сравнении со спиртами подвижность гидроксильного атома водорода в молекуле фенола (реакция со щелочью) обусловлена влиянием на гидроксильную группу соединенного с ней бензольного кольца. Гидроксильная группа в свою очередь влияет на бензольное ядро, ослабляя в орто- и пара-положениях связи атомов водорода с атомами углерода, вследствие чего атомы водорода значительно легче, чем в бензоле, замещаются атомами брома. Бензол, как известно, не реагирует с бромной водой (реагирует с чистым бромом в присутствии железа), фенол же легко реагирует с бромной водой, сразу замещая на бром три атома водорода в своей молекуле.
В демонстрационную пробирку берут немного (на кончике ножа) фенола и добавляют воды столько, чтобы при взбалтывании получился раствор (а не эмульсия) фенола. Далее прибавляют насыщенную бромную воду. Сначала образуется белая муть, а затем осадок трибромфенола:

Трибромфенол обладает устойчивым неприятным запахом, поэтому надо остерегаться попадания его на руки и одежду.
^ Качественная реакция фенола. Характерной качественной реакцией на фенолы является взаимодействие с хлоридом железа(III). К разбавленному раствору (не эмульсии!) фенола добавляют несколько капель раствора хлорида железа FeCI 3 , Жидкость окрашивается в темно-фиолетовый цвет (белый экран!).
Дезинфицирующее действие фенола. Дезинфицирующее действие фенола основано на том, что он свертывает белок, чем прекращает жизнедеятельность бактерий.
Это действие наблюдают, прибавляя к небольшому количеству раствора куриного яйца в пробирке расплавленный фенол и взбалтывая смесь.
Следует указать учащимся, что этим же свойством фенола обусловливается появление белых пятен на коже рук при неосторожном обращении с ним.
^ Нитрование фенола . При нитровании фенола образуется тринитрофенол - пикриновая кислота:

К 3 мл концентрированной азотной кислоты в пробирке приливают 1 мл (не больше) воды и в разбавленную, таким образом кислоту вносят по каплям 0,5 мл расплавленного фенола. Полученную смесь взбалтывают и нагревают до кипения. При последующем охлаждении образуются красивые желтые кристаллы пикриновой кислоты.
^ Получение фенола из салициловой кислоты . Способы получения фенола не рассматриваются в школьном курсе химии. На внеклассных занятиях (лучше после изучения кислот) можно поставить опыт получения фенола из салициловой кислоты. Существует большая аналогия между получением метана, бензола и фенола при
взаимодействии соответствующих кислот или их солей со щелочью. Везде происходит образование карбоната и соответствующего углеводорода или его производного:
CH 3 COONa + NaOH CH 4 + Na 2 CO 3
C 6 H 5 COONa + NaOH C 6 H 6 + Na 2 CO 3

Для получения фенола можно воспользоваться салицилатом натрия или непосредственно салициловой кислотой. Эти вещества могут быть приобретены в аптеке.
В пробирку с отводной трубкой помещают смесь примерно одинаковых объемов салициловой кислоты, гидроксида натрия и оксида кальция. Смесь нагревают, опустив отводную трубку в известковую воду. Убеждаются в выделении углекислого газа. Затем отводную трубку опускают в сухую пробирку и отгоняют столько фенола, сколько позволяет исходное количество салициловой кислоты. Убеждаются в получении фенола по запаху и по реакции с раствором хлорида железа. Применять холодильник приэтом, разумеется, нет необходимости.
Многоатомные спирты
– это органические
соединения, в молекулах которых содержатся две
или более гидроксильных групп, соединенных с
углеводородным радикалом.
Группы ОН в многоатомных спиртах размещаются у
разных атомов углерода:
Соединения с двумя группами ОН при одном атоме углерода неустойчивые. Они отщепляют воду и превращаются в альдегиды:
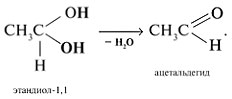
Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами).
Получение
Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха в присутствии серебряного катализатора алкены превращаются в двухатомные спирты:

Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:
На производстве глицерин получают по схеме:

Физические свойства
Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. – сладкий). Растворимость в воде – неограниченная. Температуры кипения этиленгликоля – 197,2 °С, глицерина – 290 °С. Этиленгликоль – яд.
Химические свойства
Этиленгликоль и глицерин подобны одноатомным
спиртам.
Так, они
реагируют с активными металлами
:

Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:

Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:

Качественная реакция многоатомных спиртов , позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH) 2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):

 |
УПРАЖНЕНИЯ.
1. Подчеркните структурные формулы многоатомных спиртов:
СlСН 2 СН 2 Сl, НОС 3 Н 7 , НОСН 2 СН 2 ОН,
С 2 Н 6 О 2 , 
НОСН 2 СООН, НОСН 2 СН 2 СН 2 ОН, СН 3 ОСН 2 СН 2 ОН.
2. По названиям веществ составьте их структурные формулы:
а) этандиол-1,2; б) этиленгликоль; в) пропандиол-1,2,
г) пропандиол-1,3;
д) глицерин; е) бутантриол-1,2,4.
3.
Составьте уравнения реакций
получения этиленгликоля из:
а) этилена; б) 1,2-дибромэтана.
4. Укажите пять областей применения многоатомных спиртов (этиленгликоля и глицерина).
5. Напишите уравнения реакций для цепочки химических превращений, назовите органические вещества:
6.
Составьте цепочку химических
превращений получения двухатомного спирта
СН 3 СНОНСН 2 ОН из алкана
С 3 Н 8 .
Используйте схему:
предельный углеводород
моногалогенуглеводород
непредельный углеводород дигалогенуглеводород двухатомный спирт.
Ответы на упражнения к теме 2
Урок 20
1. Подчеркнуты структурные формулы многоатомных спиртов:
2. Структурные формулы, составленные по названиям веществ:
3. Реакции получения этиленгликоля:

4. Пять областей применения многоатомных спиртов.
Этиленгликоль
(ЭГ) – в антифризах, 66%-й ЭГ
замерзает при –60 °C;
в синтезе лавсана [–СН 2 СН 2 О(О)СС(О)O–]n
;
растворитель (t
кип = 198 °С).
Глицерин
– в парфюмерии, косметике,
медицине – растворитель, компонент мазей;
для производства тринитроглицерина –
взрывчатого вещества и лекарства, расширяющего
сосуды.
5. Реакции для цепочки химических превращений:

6. Цепочка химических превращений алкана С 3 Н 8 в пропиленгликоль СН 3 СНОНСН 2 ОН через промежуточные вещества заданных классов.
представляет собой бесцветную, вязкую жидкость, простейший трехатомный спирт. Нетоксичная, без запаха, сладкая на вкус, отчего и получила свое название (гликос - сладкий). Растворяется во всех пропорциях в воде и спирте, почти не растворяется в эфире, сероуглероде, хлороформе, жирных и эфирных маслах и бензине, сильно гигроскопичен.Глицерин легко реагирует со многими органическими и неорганическими соединениями, образуя сложные эфиры, алифатические и ароматические простые эфиры и глицериды (глицераты) металлов.
Плотность 1,261 г/см³. Температура плавления - 18° C, температура кипения - 290° C.
Химическая формула: C 3 H 5 (OH) 3
Глицерин получают как побочный продукт при производстве мыла. Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта.
Промышленностью выпускаются следующие виды глицерина: натуральный сырой 1-го, 2-го и 3-го сортов (ГОСТ 6823-2000) и дистиллированный высшего сорта, 1-го и 2-го сортов (ГОСТ 6824-96).
 Применение глицерина (1, 2, 3-тригидроксипропана, 1, 2, 3-пропантриола).
Применение глицерина (1, 2, 3-тригидроксипропана, 1, 2, 3-пропантриола).
Военное дело.
Глицерин используют для получения нитроглицерина, из которого производят динамит, бездымный порох и другие взрывчатые вещества, применяемые в мирных целях и военном деле, используют в качестве незамерзающих растворов в различных двигателях, тормозной и нагревающей жидкости, для охлаждения стволов орудий.
Табачная промышленность.
Благодаря высокой гигроскопичности глицерин используют для регулирования влажности табака с целью устранения неприятного раздражающего вкуса.
Производство пластических масс.
Глицерин является ценной составной частью при получении пластмасс и смол. Эфиры глицерина широко применяют в производстве прозрачных упаковочных материалов. Например, целлофан обладает отличной гибкостью и не теряет своих свойств ни в жаре, ни в холоде.
Пищевая промышленность.
Глицерин (пищевая добавка Е422) используют для приготовления экстрактов чая, кофе, имбиря и других растительных веществ, которые измельчают, увлажняют и обрабатывают глицерином, нагревают и извлекают водой для получения экстракта, содержащего около 30 % глицерина. Глицерин широко применяют при производстве безалкогольных напитков. Глицерин используют при получении горчицы, желе и уксуса.
Сельское хозяйство.
Глицерин используют при обработке семян и сеянцев. Разбавленные растворы глицерина помогают прорастанию овса и других злаков.
Медицинская промышленность.
Глицерин находит широкое применение в медицине и производстве фармацевтических препаратов. Глицерин обладает антисептическими свойствами, поэтому его применяют для предотвращения заражения ран.
Электротехника и радиотехника.
В радиотехнике глицерин широко используют в производстве электролитических конденсаторов. Глицерин используют при производстве алкидных смол, которые применяют как изоляционный материал.
Текстильная, бумажная и кожевенная отрасли промышленности.
Глицерин в текстильной промышленности применяют в прядении, ткачестве, печатании, крашении и шлихтовании. Глицерин придает тканям эластичность и мягкость. Его используют для получения анилиновых красок, растворителей для красок, а также в качестве антисептической и гигроскопической добавки к краскам для печатания. Глицерин широко используют при производстве синтетического шелка и шерсти.
В бумажной промышленности глицерин применяют при выпуске кальки, пергамента, папиросной бумаги, бумажных салфеток и жиронепроницаемой бумаги.
В кожевенной промышленности глицерин добавляют к водным растворам хлорида бария, который используют в качестве препарата для консервирования кож. Глицерин является одним из компонентов восковых эмульсий для дубления кож.
Лакокрасочная промышленность.
Глицерин - ценный компонент полировочных составов, особенно лаков, применяемых для окончательной отделки.
Производство моющих и косметических средств.
Большое количество сортов туалетного мыла содержит глицерин, который усиливает его моющую способность, придает белизну коже и смягчает ее. Глицериновое мыло способствует удалению красящих веществ кожи, загоревшей на солнце. В косметике полиолы используются в качестве увлажнителей. Глицерин - натуральный продукт, получаемый при гидролизе растительных масел. Обладая гигроскопичными свойствами, он увлажняет кожу, придавая ей мягкость и эластичность.
Другие области применения.
Для изготовления замазок, гектографической массы, копировальных чернил, штемпельных красок, в кожевенном деле и для других целей.
| Наименование показателя | Норма для сортов | |||
| первого | второго | третьего | ||
| марки 1 | марки 2 | |||
| Массовая доля чистого глицерина, %, не менее | 86 | 86 | 82 | 78 |
| Реакция глицерина, см³ 0,1 моль/дм³ (0,1 н.) раствора HCl или КОН, не более | 6,0 | 6,0 | 6,0 | 6,0 |
| Массовая доля золы, %, не более | 0,35 | 1,80 | 3,00 | 9,50 |
| Массовая доля нелетучего органического остатка, не более | 0,85 | 2,0 | 3,0 | 4,0 |
| Жирные кислоты и смолы (качественная реакция) | Отсутствие | Следы | ||
| Сернокислые соединения (сульфаты) (качественная реакция) | То же | То же | ||
| Реакция на поверхностно-активные вещества (ПАВ) в глицерине, см³ 0,1 моль/дм³ (0,1 н.) раствора HCl, не более | 2,0 | 5,0 | 6,0 | Не нормируются |
| Белковые вещества в глицерине, поступающем на дистилляцию (качественная реакция) | Отсутствие | То же | ||
Требования безопасности.
Сырой глицерин - горючий, нетоксичный продукт.
Глицерин термически неустойчив, при длительном нагреве (даже до 90-130° C) разлагается с образованием легковоспламеняющихся веществ (акролеина, ацетона), понижающих температуру вспышки до 112° C.
Не допускается применять открытый огонь в местах хранения сырого глицерина и проведения работ с ним.
Производственные помещения, в которых проводят работы с сырым глицерином, должны быть оборудованы приточно-вытяжной вентиляцией.